Un documento de la FDA publicado recientemente recuerda a los médicos y a los pacientes la necesidad de hacer un seguimiento anual con imágenes de por vida en aquellos que hayan recibido una endoprótesis Endologix AFX para tratar un aneurisma de aorta abdominal. El motivo de este seguimiento de por vida es el riesgo de leaks tipo III.
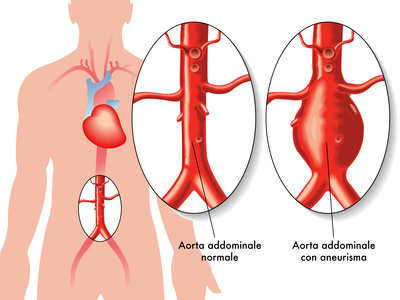
El año pasado la FDA había alertado sobre el tema al conocerse el dato de que esta endoprótesis tenía una chance acumulativa del 2.5% de reintervenciones debido a leaks tipo IIIa y IIIb.
En la reciente comunicación la agencia recomendó un seguimiento de por vida y continúa evaluando evidencia para saber si el riesgo de leaks es aún mayor.
Los últimos datos surgieron de una publicación en The Journal of Vascular Surgery en la que se analizaron a más de 600 pacientes. Luego de 2 años de seguimiento se observó una tasa de leaks tipo 3 del 4% con el dispositivo AFX Strata, del 5.1% con el AFX Duraply y del 14.1% con el AFX2, aunque es difícil evaluar esta última versión del dispositivo por los pocos pacientes incluidos.
La FDA también recordó otras dos presentaciones que todavía no llegaron al papel. En uno de los trabajos el 25% de los pacientes tratados con el AFX requirieron reintervención, murieron o evolucionaron con ruptura del aneurisma a 4 años de seguimiento. La otra presentación mostró un aumento marcado y significativo de las rupturas del dispositivo a partir de los 3 años. Con toda esta información y otra que está en curso la FDA está haciendo la vigilancia postmarket del dispositivo.
Lea también: Nivel NT-proBNP identifica quienes se benefician y quiénes no del TAVI.
El panel de vigilancia de dispositivos endovasculares se está ocupando del riesgo de leaks tipo III con el dispositivo AFX, de las opciones de tratamiento si se presenta una complicación y de futuras estrategias de vigilancia para los pacientes que recibieron el dispositivo para tratar un aneurisma de aorta abdominal infrarrenal.
UPDATE-The-FDA-Reminds-Patients-and-Health-Care-Providers-of-the-Importance-of-At-Least-YearlyTítulo original: UPDATE: The FDA reminds patients and health care providers of the importance of at least yearly, lifelong follow-up with use of Endologix AFX endovascular AAA graft systems: FDA Safety Communication.
Referencia: US Food and Drug Administration. Published and accessed on: December 4, 2020.
Suscríbase a nuestro newsletter semanal
Reciba resúmenes con los últimos artículos científicos





