Um documento da FDA recentemente publicado traz um lembrete aos médicos e aos pacientes sobre a necessidade de fazer um seguimento anual com imagens por toda a vida naqueles pacientes que tenham recebido uma endoprótese Endologix AFX para tratar um aneurisma de aorta abdominal. O motivo de dito seguimento por toda a vida é o risco de regurgitações tipo III.
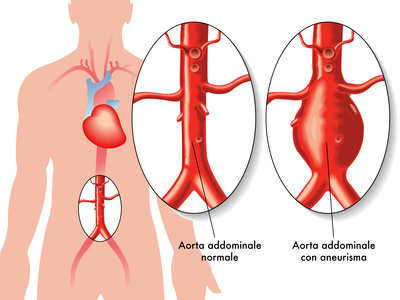
No ano passado a FDA tinha alertado sobre o tema ao conhecer-se o dado de que esta endoprótese tinha uma chance acumulativa de 2,5% de reintervenções devido a regurgitações tipo IIIa e IIIb.
Na recente comunicação a agência recomendou um seguimento por toda a vida e continua avaliando evidência para saber se o risco de regurgitações é ainda maior.
Os últimos dados surgiram de uma publicação do The Journal of Vascular Surgery na qual foram analisados mais de 600 pacientes. Depois de 2 anos de seguimento observou-se uma taxa de regurgitações tipo 3 de 4% com o dispositivo AFX Strata, de 5,1% com o AFX Duraply e de 14,1% com o AFX2, embora seja difícil avaliar esta última versão do dispositivo devido ao fato de haver poucos pacientes incluídos.
A FDA também recordou outras duas apresentações que ainda não chegaram ao papel. Em um dos trabalhos, 25% dos pacientes tratados com o AFX requereram reintervenção, morreram ou evoluíram com ruptura do aneurisma em 4 anos de seguimento. A outra apresentação mostrou um aumento marcante e significativo das rupturas do dispositivo a partir dos 3 anos. Com toda essa informação e outra que está em andamento a FDA está fazendo a vigilância postmarket do dispositivo.
Leia também: Nível NT-proBNP identifica quem se beneficia e quem não se beneficia com o TAVI.
O painel de vigilância de dispositivos endovasculares está se ocupando do risco de regurgitações tipo III com o dispositivo AFX, das opções de tratamento caso se apresente uma complicação e de futuras estratégias de vigilância para os pacientes que receberam o dispositivo para tratar um aneurisma de aorta abdominal infrarrenal.
UPDATE-The-FDA-Reminds-Patients-and-Health-Care-Providers-of-the-Importance-of-At-Least-YearlyTítulo original: UPDATE: The FDA reminds patients and health care providers of the importance of at least yearly, lifelong follow-up with use of Endologix AFX endovascular AAA graft systems: FDA Safety Communication.
Referência: US Food and Drug Administration. Published and accessed on: December 4, 2020.
Subscreva-se a nossa newsletter semanal
Receba resumos com os últimos artigos científicos





