A U.S. Food and Drug Administration (FDA) deu luz verde à válvula SAPIEN 3 com o pré-stent adaptativo Alterra para implantação em posição pulmonar.
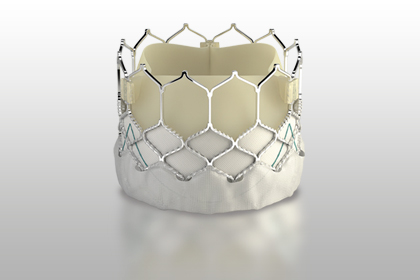
Segundo a Edwards Lifesciences, esse novo sistema, pensado para a valva pulmonar, pode compensar uma grande variedade de tamanhos e morfologias da via de saída do ventrículo direito, permitindo um implante estável da válvula.
A aprovação dessa nova ferramenta é muito bem recebida por todos os pacientes com cardiopatias congênitas que já tiveram que passar por múltiplas cirurgias corretivas cardíacas ao longo da sua vida.
A Alterra é uma oportunidade a mais, com um procedimento muito menos invasivo para esses pacientes.
A FDA aprovou o dispositivo para o tratamento de crianças ou adultos com insuficiência pulmonar severa no ecocardiograma, com uma via de saída nativa ou já corrigida cirurgicamente e com indicação de substituição da valva pulmonar.
A começos de ano, o mesmo organismo regulador aprovou o dispositivo Harmony, uma válvula pulmonar por cateter produzida pela Medtronic.
A Harmony foi a primeira válvula não cirúrgica aprovada para tratar a insuficiência pulmonar em pacientes pediátricos ou adultos com vias de saída nativas ou já corrigidas.
A concorrência das válvulas por cateter está em alta (para as 4 valvas) e ainda existem muitos dispositivos com vantagens potenciais em processo de aprovação.
Sem dúvida, teremos muitas notícias como essa nos próximos meses, o que aumentará nosso leque de possibilidades para realizar melhores tratamentos.
Título original: Edwards LifeSciences. Edwards receives FDA approval for SAPIEN 3 with Alterra prestent for transcatheter pulmonic valve replacement.
Referência: Publicado por la FDA el 20 de diciembre 2021.
Subscreva-se a nossa newsletter semanal
Receba resumos com os últimos artigos científicos





