Luego de que se reportaran algunos eventos adversos serios con la primera generación de Lotus, ésta fue retirada del mercado, pero su concepto único no iba a quedar en el tintero. Ahora, vuelve renovada y con la aprobación de la FDA, lo cual genera una competencia directa con las dos líderes (Sapien y CoreValve) que hasta ahora eran las únicas aprobadas para utilizarse en el mercado de los Estados Unidos.
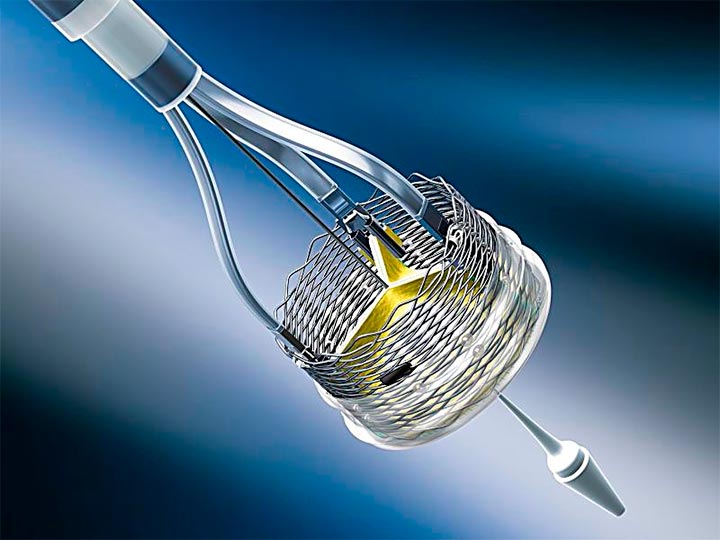 A partir de ayer, el mercado de Estados Unidos cuenta con 3 posibilidades de válvulas percutáneas, las tres con conceptos diferentes y sus respectivas ventajas y desventajas. Esto podría ser visto como una competencia entre los 3 dispositivos, pero en realidad lo más probable es que se terminen complementando. Lo que tenemos que buscar es la válvula más adecuada para cada paciente.
A partir de ayer, el mercado de Estados Unidos cuenta con 3 posibilidades de válvulas percutáneas, las tres con conceptos diferentes y sus respectivas ventajas y desventajas. Esto podría ser visto como una competencia entre los 3 dispositivos, pero en realidad lo más probable es que se terminen complementando. Lo que tenemos que buscar es la válvula más adecuada para cada paciente.
La US Food and Drug Administration (FDA) acaba de aprobar el sistema de reemplazo de aorta por catéter Lotus Edge para pacientes con alto riesgo quirúrgico.
Lea también: REPRISE III: Lotus y CoreValve se miden en pacientes de alto riesgo o inoperables.
Soportan la decisión de la FDA los resultados del estudio REPRISE III que utilizó la primera generación del dispositivo, pero también incluyó en el registro pacientes que recibieron la válvula Lotus Edge.
Los resultados del REPRISE III fueron presentados en el EuroPCR 2017 y mostraron que el sistema Lotus no era inferior a los resultados de una población que había recibido tanto la primera generación de CoreValve como la segunda (Evolut R).
Las críticas a las Lotus cayeron sobre su alta tasa de requerimiento de marcapasos, un problema que fue en parte resulto con una modificación del diseño original conocido con “depth guard”. Esta modificación ayuda a evitar un implante demasiado profundo y limitar la interacción con el tracto de salida.
Lea también: Válvula Lotus en pacientes de la vida real: la cuasi ausencia de leaks es su mayor fortaleza.
El seguimiento a 2 años del REPRISE III (publicado recientemente) confirmó los primeros resultados de la única válvula del mercado que puede ser completamente liberada, evaluar su función y si ésta no fuera la esperada (leak, bloqueo, etc) puede ser todavía completamente recapturada para optimizar el resultado al máximo.
A principios de este año comenzó el enrolamiento de pacientes para el REPRISE IV que incluye pacientes de riesgo intermedio con la Lotus Edge.
La aprobación de la FDA podría indirectamente aumentar el uso de dispositivos de protección cerebral durante el procedimiento ya que Boston compró los derechos del dispositivo Sentinel el año pasado y muchos especulan con que la válvula y el dispositivo de protección cerebral podrían salir a la venta en combinación.
Título original: Boston Scientific receives FDA approval for LOTUS Edge aortic valve system. Published on: April 23, 2019. Accessed on: April 24, 2019.
Reciba resúmenes con los últimos artículos científicosSuscríbase a nuestro newsletter semanal
Su opinión nos interesa. Puede dejar su comentario, reflexión, pregunta o lo que desee aquí abajo. Será más que bienvenido.





