Depois de terem sido relatados alguns eventos adversos sérios com a primeira geração do dispositivo Lotus, o mesmo foi retirado do mercado, mas seu conceito único não podia ser desaproveitado. Agora, volta renovado e com a aprovação da FDA, o que gera uma concorrência direta com os dois dispositivos líderes (Sapien e CoreValve), que até agora eram as únicas válvulas aprovadas para serem utilizadas no mercado dos Estados Unidos.
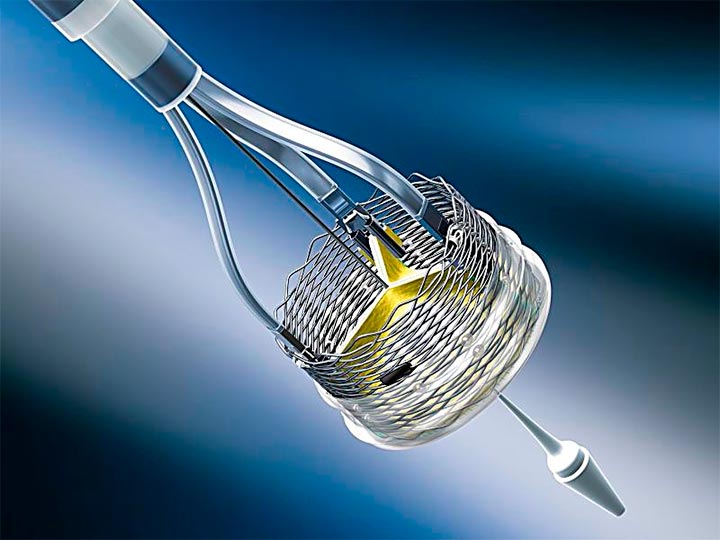 Desde ontem, o mercado estadunidense conta com 3 possibilidades de válvulas percutâneas, as três com conceitos diferentes e suas respectivas vantagens e desvantagens. Isso poderia ser visto como uma concorrência entre os 3 dispositivos, mas o mais provável é que eles terminem se complementando. O que temos que buscar é a válvula mais adequada para cada paciente.
Desde ontem, o mercado estadunidense conta com 3 possibilidades de válvulas percutâneas, as três com conceitos diferentes e suas respectivas vantagens e desvantagens. Isso poderia ser visto como uma concorrência entre os 3 dispositivos, mas o mais provável é que eles terminem se complementando. O que temos que buscar é a válvula mais adequada para cada paciente.
A US Food and Drug Administration (FDA) acaba de aprovar o sistema Lotus Edge de substituição percutânea da aorta para pacientes com alto risco cirúrgico.
Leia também: REPRISE III: Lotus e CoreValve são medidos em pacientes de alto risco ou inoperáveis.
Respaldam a decisão da FDA os resultados do estudo REPRISE III que utilizou a primeira geração do dispositivo, mas também incluiu no registro pacientes que receberam a válvula Lotus Edge.
Os resultados do REPRISE III foram apresentados no EuroPCR 2017 e mostraram que os resultados do sistema Lotus não eram inferiores aos de uma população que tinha recebido tanto a primeira geração do dispositivo CoreValve quanto a segunda (Evolut R).
As críticas às válvulas Lotus se relacionaram com sua alta taxa de requerimento de marca-passo, um problema que foi em parte resolvido com uma modificação do design original conhecido como “depth guard”. Dita modificação ajuda a evitar um implante demasiadamente profundo e limitar a interação com o orifício de saída.
Leia também: Válvula Lotus em pacientes da vida real: a quase ausência de regurgitação é sua maior fortaleza.
O seguimento de 2 anos do REPRESE III (recentemente publicado) confirmou os primeiros resultados da única válvula do mercado que pode ser completamente liberada, avaliar sua função e se esta não for a esperada (por regurgitação, bloqueio, etc.) pode, ainda, ser completamente recapturada para otimizar o resultado máximo.
No princípio deste ano começou o recrutamento de pacientes para o REPRISE IV, que inclui pacientes de risco intermediário com a válvula Lotus Edge.
A aprovação da FDA poderia, de forma indireta, aumentar o uso de dispositivos de proteção cerebral durante o procedimento, já que a Boston comprou os direitos do dispositivo Sentinel no ano passado e muitos especulam que a válvula e o dispositivo de proteção cerebral poderiam ser vendidos em pacote.
Título original: Boston Scientific receives FDA approval for LOTUS Edge aortic valve system. Published on: April 23, 2019. Accessed on: April 24, 2019.
Receba resumos com os últimos artigos científicosSubscreva-se a nossa newsletter semanal
Sua opinião nos interessa. Pode deixar abaixo seu comentário, reflexão, pergunta ou o que desejar. Será mais que bem-vindo.





